細胞凍存有哪些注意事項���?
關(guān)鍵詞:細胞實(shí)驗外包 細胞培養 實(shí)驗室 細胞培養 干細胞 細胞檢測 第三方檢測機構
細胞培養的傳代及日常維持過(guò)程中�����,在培養器具�����、培養液及各種準備工作方面都需大量的耗費�,而且細胞一旦離開(kāi)活體開(kāi)始原代培養�,它的各種生物特性都將逐漸發(fā)生變化并隨著(zhù)傳代次數的增加和體外環(huán)境條件的變化而不斷有新的變化�。因此及時(shí)進(jìn)行細胞凍存十分必要��。細胞冷凍儲存在-70℃冰箱中可以保存一年之久;細胞儲存在液氮中��,溫度達-196℃����,理論上儲存時(shí)間是無(wú)限的�。
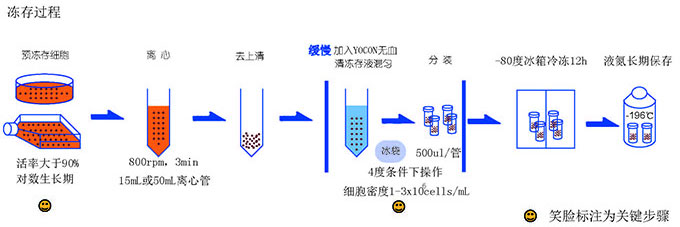
細胞凍存的步驟:
配制含 10%DMSO 或甘油����、10~20% 小牛血清的凍存培養液;
取對數生長(cháng)期的細胞��,去除舊培養液���,用 PBS 清洗����。
去除 PBS�,加入適量胰蛋白酶 (覆蓋培養皿表面) 把單層生長(cháng)的細胞消化下來(lái);
離心 1000rpm����,5min;
去除胰蛋白酶�,加入適量配制好的凍存培養液��,用吸管輕輕吹打使細胞均勻��,計數�����,調節凍存液中細胞的最終密度為 5×106/ml~1×107/ml;
將細胞分裝入凍存管中���,每管 1~1.5 ml;
在凍存管上標明細胞的名稱(chēng)����,凍存時(shí)間及操作者;
凍存:標準的凍存程序為降溫速率-1~-2℃/ min;當溫度達-25℃以下時(shí)���,可增至-5℃~-10℃/min;到-100℃時(shí)�����,則可迅速浸入液氮中���。也可將裝有細胞的凍存管放入-20℃冰箱 2h �����,然后放入-70℃冰箱中過(guò)夜�����,取出凍存管�,移入液氮容器內���。
關(guān)于細胞凍存的注意事項:
1. 為保持細胞最大存活率����,一般都采用慢凍存融的方法���。
2. 凍存物距液氮面越近溫度越低����。標準的低凍速度為-1℃~12℃/ 分鐘�,當溫度下降達-25℃時(shí)����,下降速度可增至-5~-10℃/ 分鐘���,到-100℃時(shí)則可迅速凍入液氮中�。因此要適當掌握凍存物下降入液氮中的速度���,過(guò)快能影響細胞內水分透出�����,太慢則促冰晶形成�。
3. 初次凍存者在下降凍存時(shí)�,宜先用細木棒伸入罐中探測液面位置����,然后需用溫度計與凍存物并行的辦法��,以觀(guān)測下降凍存物的速度����、凍存物與液氮液面距離和溫度三者關(guān)系��,當已掌握以上各參數和凍存技術(shù)熟練后�,僅按下降時(shí)間和下降距離便可獲理想凍存效果��。
4. 各種細胞對凍存速度的要求也不一樣�����;上皮細胞和成纖維細胞耐受性可能大些�����,骨髓干細胞-2~-3℃/ 分鐘合適����;胚胎細胞耐受性較小���,不宜太快���??傊谝婚_(kāi)始時(shí)����,下降速度不能超過(guò)-10℃/ 分鐘����。
5. 用什么防護劑合適和用量多大�����,要依細胞而定�����,初代培養細胞用 DMSO 較好��,一般細胞可用甘油���;用量以較小為好���。有人認為人皮膚上皮細胞貯存在 20%-30% 甘油中很好�。
6. 原則上細胞在液氮中可貯存多年����,但為妥善起見(jiàn)�,凍存一年后����,應再復蘇培養一次��,然后再繼續凍存��。
7. 將凍存管放入液氮容器或從中取出時(shí)�����,要做好防護工作����,以免凍傷
8. 注意自身的安全���,對于來(lái)自人源性或病毒感染的細胞株應特別小心��。操作過(guò)程中�,應避免引起氣溶膠的產(chǎn)生�,小心有毒性試劑例如 DMSO�,并避免尖銳物品傷人等��。

 服務(wù)熱線(xiàn)
服務(wù)熱線(xiàn) 聯(lián)系電話(huà)
聯(lián)系電話(huà) 公司地址
公司地址